주요 차이 - S 궤도 대 P Orbital
원자는 핵 주위의 어느 방향 으로든 연속적인 움직임으로 구성된 전자로 구성됩니다. 그들이 핵 주위에 움직이고 있기 때문에, 우리는 주어진 순간에 그 전자의 정확한 위치를 결정할 수 없습니다. 우리는 전자가 위치에있을 확률 만 추측 할 수 있습니다. 이 현상을 Heisenberg 불확실성 원리 이라고합니다 . 이러한 확률에 따르면, 전자가 가장 높은 확률로 발견 될 수있는 영역은 궤도라는 용어로 설명됩니다. 핵 주위의 전자의 에너지와 움직임에 따라 다른 궤도가있을 수 있습니다. 궤도와 p 궤도는 그러한 궤도입니다. S 궤도와 P 궤도의 주요 차이점은 s 궤도는 구형 모양이고 P 궤도는 아령 모양입니다.
주요 영역을 다루었습니다
1. s orbital
- 정의, 모양 및 구조적 특성
2. P Orbital 이란 무엇입니까?
- 정의, 모양 및 구조적 특성
3. s 궤도와 p 궤도의 유사점은 무엇입니까
- 일반적인 기능의 개요
4. s 궤도와 p 궤도의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :원자, Heisenberg 불확실성 원리, 궤도, p 궤도, 확률, s 궤도 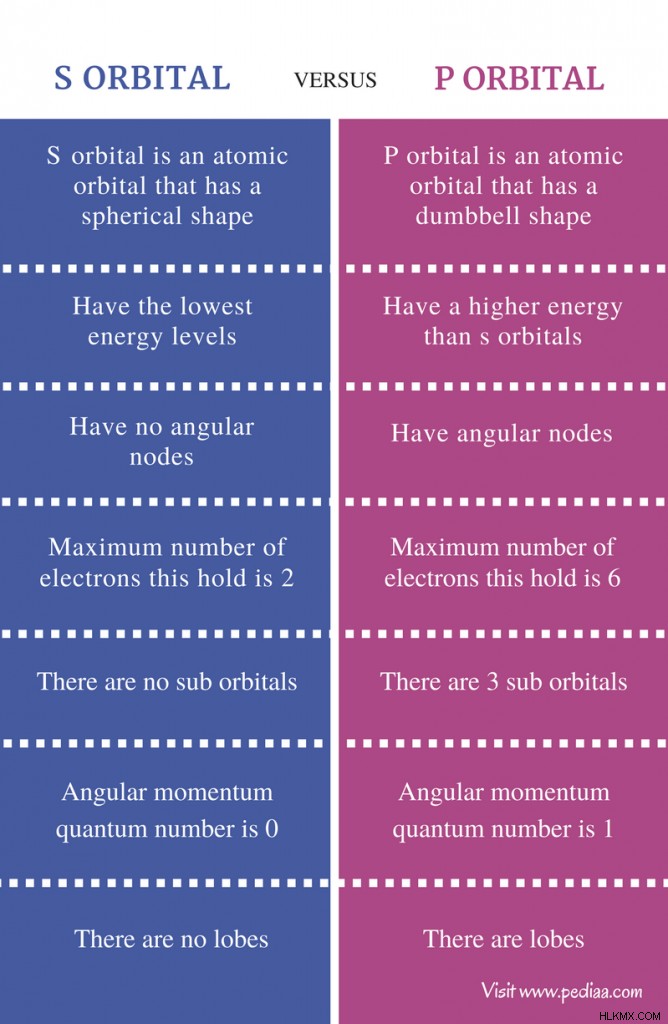
s orbital
s 궤도는 구형 모양을 가진 원자 궤도입니다. 다른 원자 궤도와 비교할 때 가장 낮은 에너지가 있습니다. 각 전자 쉘에는 적어도 하나의 궤도가 있습니다. S orbital은 다른 궤도 중에서 가장 간단한 원자 궤도입니다. 하나의 궤도는 최대 2 개의 전자를 보유 할 수 있습니다. s 궤도에는 하위 궤도가 없습니다. 문자“S”는“Sharp”의 의미입니다. 따라서이 궤도는 그 궤도에서 전자의 각 운동량을 고려하여 명명되었습니다. 원자 궤도는 명확한 에너지 수준 (에너지가 양자화)으로 구성되기 때문에 양자 수가 제공됩니다. s 궤도는 원자의 각 운동량 양자 수를 할당합니다.

그림 1 :원리 양자 수가 증가함에 따라 S 궤도의 크기가 증가합니다
S 궤도의 두 전자는 반대편 스핀을 가지고 있습니다. S 궤도는 화학적 결합에 관여합니다. 그들은 시그마 본즈의 형성에 참여할 수 있습니다. 그러나 이러한 궤도는 PI 결합을 형성 할 수 없습니다. 구형 모양은 전자를 찾을 수있는 가장 가능성있는 영역을 알려줍니다. s 궤도에는 각도 노드가 없습니다. 따라서, s 궤도의 각 운동량 양자 수는 0입니다.
s 궤도는 동일한 전자 쉘에서 다른 모든 궤도 중에서 가장 낮은 에너지를 가지고 있습니다. 더 높은 전자 쉘 (원칙 양자 수 =N)에서, S 궤도는 가장 가까운 하부 쉘 (N-1)에서 D 궤도보다 에너지보다 낮은 에너지를 갖는다. S 궤도 구의 크기는 원리 양자 수가 증가함에 따라 증가합니다.
p orbital
p orbital은 아령 모양의 원자 궤도입니다. P 궤도는 S 궤도보다 에너지가 더 높다. "P"문자는 "교장"을 나타냅니다. 그것은 p 궤도에서 전자의 각 운동량을 설명합니다. 하나의 궤도는 최대 6 개의 전자를 보유 할 수 있습니다. 이 전자는 아 원자의 궤도를 차지합니다. 하나의 아 원자 궤도는 최대 2 개의 전자 만 담을 수 있습니다. 따라서, 하나의 p 궤도에는 3 개의 아 원자 궤도가있다. 그들은 px, py 및 pz로 명명되었습니다. 일반적으로,이 모든 것을 p 궤도라고합니다.
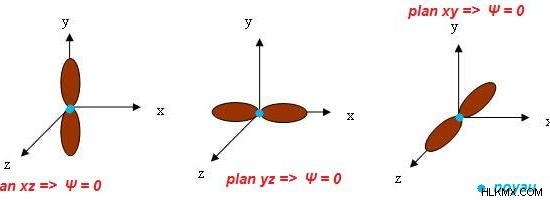
그림 2 :3 개의 p 궤도의 모양과 방향
p 궤도의 세 가지 하위 궤도는 원자에서 이러한 궤도의 방향에 따라 서로 다릅니다. 그러나 그들은 모양이 비슷합니다. 이 모든 하위 orbitals는 아령 모양입니다. p 궤도에 대한 특별한 특징 중 하나는 각도 노드로 구성된다는 것입니다. 따라서, p 궤도의 각 운동량 양자 수는 1입니다.
원칙적 양자 번호 1을 갖는 전자 쉘을 제외하고 다른 모든 전자 쉘은 p 궤도로 구성됩니다. P 궤도의 크기는 주요 양자 수가 증가함에 따라 증가합니다. 하나의 p 궤도에는 두 개의 엽이 있습니다. 이 엽은 축을 따라 대칭입니다. 이러한 P 궤도는 화학적 결합에 관여합니다. 그들은 시그마 본드 또는 PI 결합을 형성 할 수 있습니다. 수평 방향의 p 하위 궤도는 시그마 본드를위한 것일 수 있습니다. 다른 두 개의 하위 orbitals는 pi 결합과 관련이 있습니다.
s 궤도와 p 궤도 사이의 유사성
- s orbital과 p orbital은 원자 궤도의 유형입니다.
- 두 용어는 그 궤도에서 전자의 각 운동량을 설명합니다.
- 두 궤도 모두 시그마 본딩에 관여합니다.
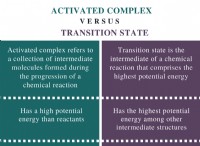
s 궤도와 p 궤도의 차이
정의
s 궤도 : s 궤도는 구형 모양을 가진 원자 궤도입니다.
p Orbital : p orbital은 아령 모양의 원자 궤도입니다.
에너지 수준
s 궤도 : s 궤도는 에너지 수준이 가장 낮습니다.
p Orbital : p 궤도는 s 궤도보다 에너지가 더 높다.
각도 노드
s 궤도 : s 궤도에는 각도 노드가 없습니다.
p Orbital : p 궤도는 각도 노드를 갖는다
최대 전자 수
s 궤도 : 궤도가 담을 수있는 최대 전자 수는 2입니다.
p Orbital : p 궤도가 담을 수있는 최대 전자 수는 6입니다.
하위 궤도
s 궤도 : s 궤도에는 하위 궤도가 없습니다.
p Orbital : p 궤도에는 3 개의 하위 궤도가 있습니다.
각 운동량 양자 수
s 궤도 : 궤도의 각 운동량 양자 수는 0입니다.
p Orbital : p 궤도의 각 운동량 양자 수는 1입니다.
로브
s 궤도 : s orbitals에는 엽이 없습니다.
p Orbital : p 궤도에는 엽이 있습니다.
결론
orbitals와 p orbitals는 원자 궤도입니다. 이 궤도는 그 원자의 전자를 찾을 수있는 가장 가능성있는 영역을 나타냅니다. S 궤도와 P 궤도의 주요 차이점은 S 궤도는 구형 모양이고 P 궤도는 아령 모양이라는 것입니다.